L’intenzione di costituire una banca dati per i dispositivi medici centralizzata a livello di Unione è stata manifestata dalla Commissione già nel 2010 con la Decisione 2010/227/UE, ma è con la pubblicazione e l’applicazione del Regolamento (UE) 2017/745 che questo progetto è stato avviato.
Una delle più interessanti novità portate dal Regolamento è infatti la creazione di Eudamed, una piattaforma volta a raccogliere i dati di tutti i dispositivi medici presenti sul mercato, gli operatori economici, i certificati di conformità, gli organismi notificati, la vigilanza e la sorveglianza.
Gli obiettivi primi che il Consiglio e il Parlamento Europeo si sono posti sono:
- migliorare l’accesso alle informazioni per il pubblico e gli operatori sanitari;
- razionalizzare e facilitare il flusso di informazioni tra operatori economici;
- agevolare il coordinamento tra i Paesi membri dell’UE;
- rendere più trasparenti la vigilanza e la sorveglianza del mercato.
Struttura
Il sistema è strutturato in 6 moduli per raccogliere le informazioni sui dispositivi medici, sugli operatori economici e sul mercato:
- Registrazione degli attori
- Identificazione univoca dei dispositivi (UDI) e registrazione del dispositivo
- Organismi notificati e certificati
- Indagini cliniche e studi sulle prestazioni
- Vigilanza e sorveglianza post-vendita
- Sorveglianza del mercato
Attualmente i moduli disponibili sono i primi 3, è possibile infatti già trovare gli operatori economici che hanno eseguito la registrazione, il loro dispositivi medici e gli enti notificati e alcuni dei certificati da essi rilasciati.
Utilizzo della piattaforma
La procedura di registrazione dell’attore deve essere effettuata accedendo al portale EU Login e inserendo nel form i dati dell’operatore economico che presenta la richiesta. Quest’ultima viene sottoposta a verifica e approvazione da parte dell’Autorità Competente nazionale (in Italia, il Ministero della Salute) che la approva o richiede integrazioni. Approvata la richiesta, viene assegnato all’attore un codice identificativo univoco, denominato SRN (Single Registration Number).
Qui una guida del Ministero della Salute sulla registrazione degli operatori economici.
La registrazione dei dispositivi prevede l’indicazione dello UDI-DI di base, degli UDI-DI attribuiti, dell’EMDN (European Medical Device Nomenclature) e l’indicazione di dettagliate informazioni sulle caratteristiche dei dispositivi.
A questo link è disponibile una guida pubblicata dalla Commissione Europea.
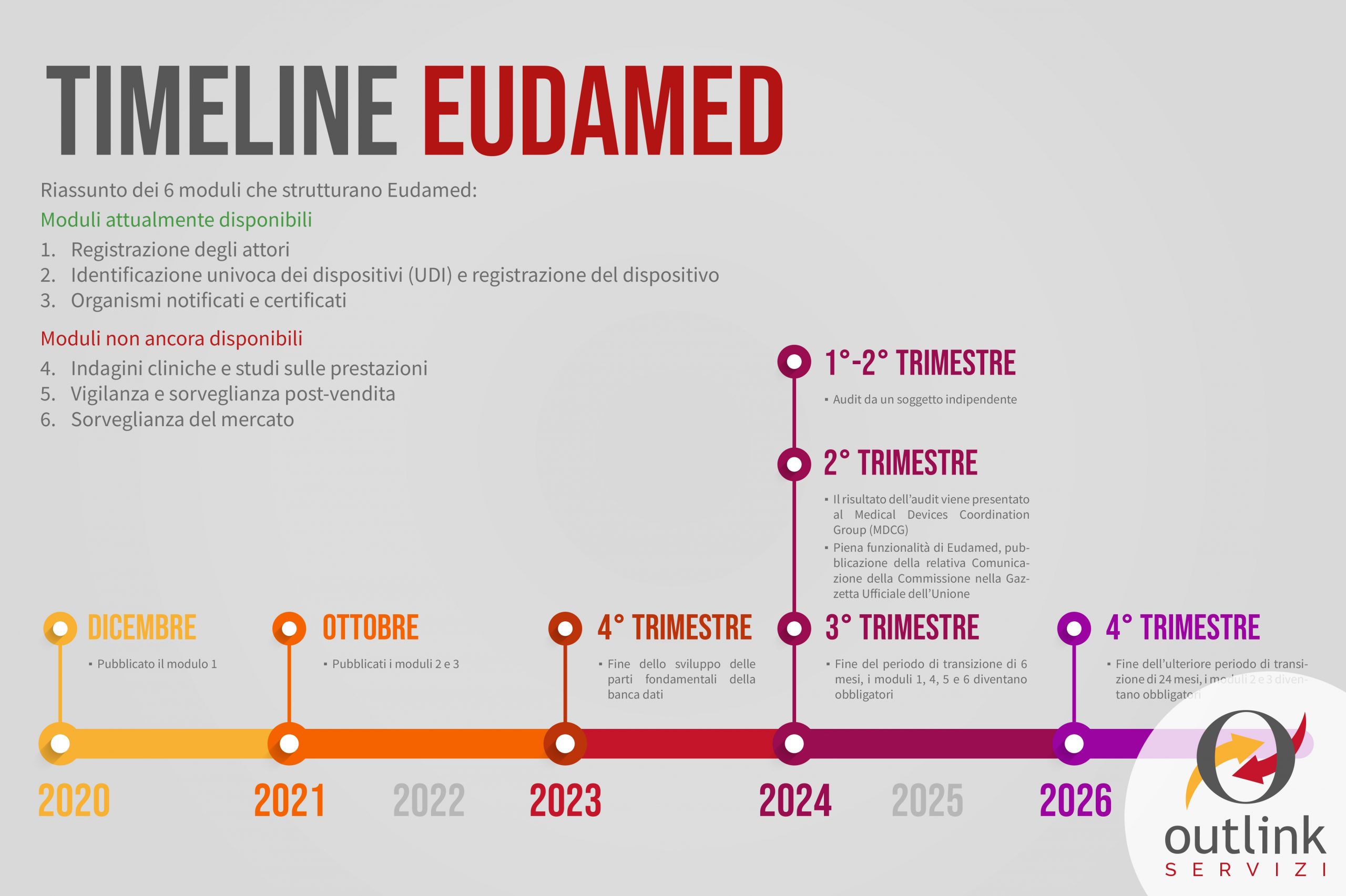
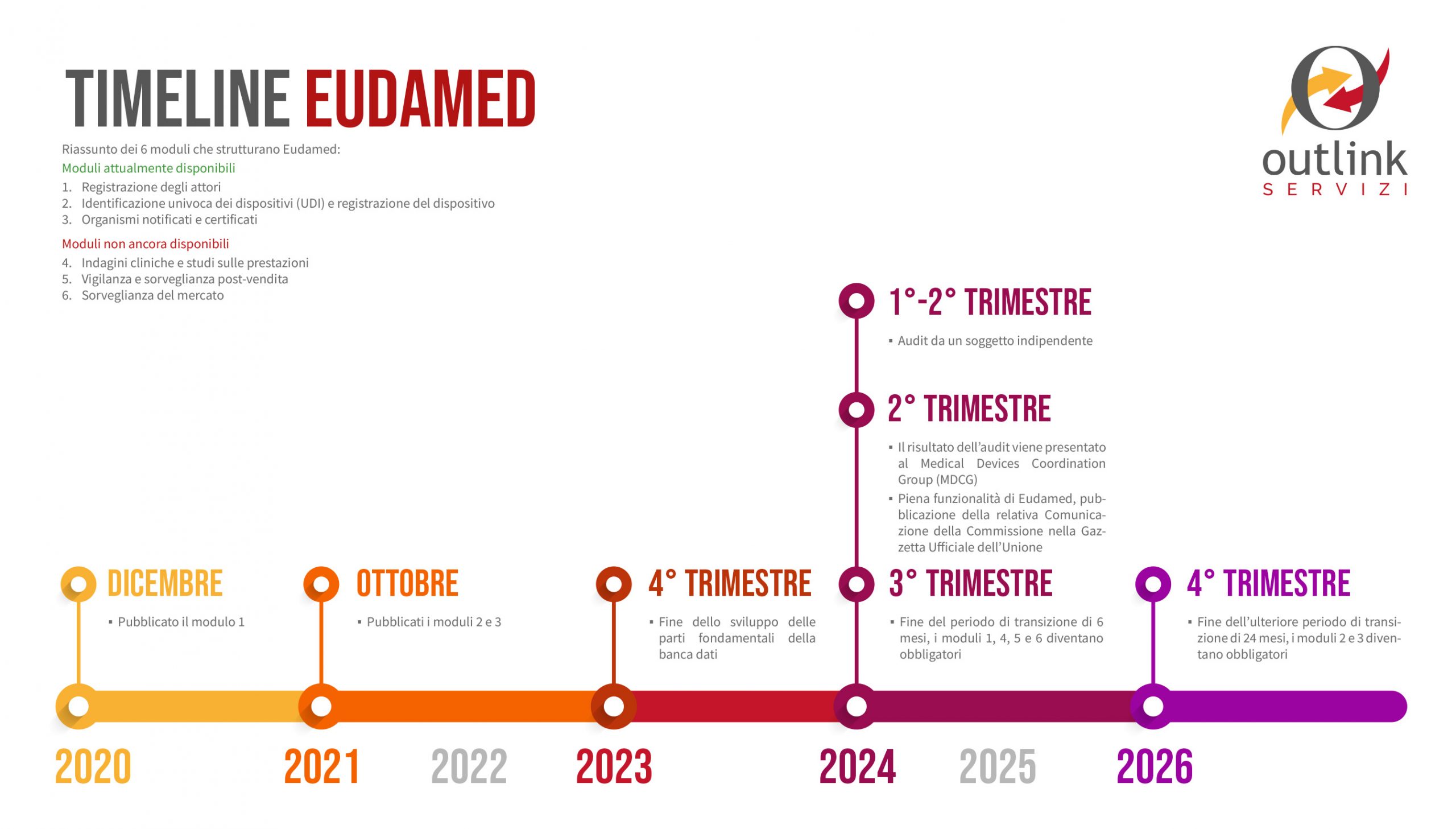
Timeline
Con la premessa che l’uso di EUDAMED non è ancora obbligatorio, ma caldamente consigliato, riportiamo di seguito la timeline e le deadline fissate dalla stessa Commissione Europea:
- 12/2020 – Pubblicato il modulo 1;
- 10/2021 – Pubblicati i moduli 2 e 3;
- Q4, 2023 – Fine dello sviluppo delle parti fondamentali della banca dati;
- Q1 – Q2, 2024 – Audit da un soggetto indipendente;
- Q2, 2024 – Il risultato dell’audit viene presentato al Medical Devices Coordination Group (MDCG);
- Q2, 2024 – Piena funzionalità di Eudamed, pubblicazione della relativa Comunicazione della Commissione nella Gazzetta Ufficiale dell’Unione;
- Q4, 2024 – Fine del periodo di transizione di 6 mesi, i moduli 1, 4, 5 e 6 diventano obbligatori;
- Q4, 2026 – Fine dell’ulteriore periodo di transizione di 24 mesi, i moduli 2 e 3 diventano obbligatori.